化学推断题
概括:这道题是东怂拦同学的课后化学练习题,主要是关于化学推断题,指导老师为历老师。物质推断题是历届中考化学必有的压轴好戏,分值5分,难度很大,是试卷上最耗时的一题,它要求学生对初中化学的各个知识点都要掌握并且要十分熟悉。考察的知识主要在碳三角(C、CO、CO2),氧三角(O2、H20、H2O2),四种初中化学基本反应类型,另外还有难度较大的酸、碱、盐知识等,要求学生对初中所学的各个化学反应都很熟悉。
题目:化学推断题
解:推断题的常见突破口
1.物质特征
⑴ 固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4?5H2O(蓝色)、S(黄色).
⑵ 溶液颜色:含有Cu2+(蓝色);含有Fe2+(浅绿色);含有Fe3+(黄色).
⑶常见固体单质有Fe、Cu、C、S;气体单质有H2、N2、O2;无色气体有H2、N2、O2、CO、CO2、CH4、SO2;常温下呈液态的物质有H2O.
2.现象特征
⑴ 火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色).
⑵沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色).
⑶ 能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体是O2.
⑷ 能使白色无水CuSO4粉末变蓝的气体是水蒸气.
3.反应特征
⑴ 能使澄清石灰水变浑浊的无色无味气体是CO2.
⑵ 能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C.
⑶ 在O2中燃烧火星四射的物质是Fe.
⑷ 在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等.
⑸ 能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4.
推断题解题的常用方法
1.一点击破 顺藤摸瓜
有些推断题,涉及曲折迂回的转化历程,同学们总觉得无从下手,只要抓住题目的明显条件(即“突破口”)得出直接结论.常用顺推的方法,沿正向思路分析推理,顺藤摸瓜逐步得出结论. 2. 逆向思维 反向推断
有些推断题,利用题给条件(即“果”)探求未知(即“因”).同学们可以运用物质相互反应规律由因究果的思维方法进行逆向推理,得出结论.
3.提出假设 逐一论证
有些推断题,可以根据题给条件,提出假设,然后归纳推敲筛选,得出合理的假设范围,最后验证得出的结论.
4.发散思维各个击破
有些推断题,可以根据各部分的已知条件,分别得出相应的结论,各个击破,然后综合推断,得出相应结论.
5.多练
适当找一些典型的化学推断题进行练习,可以帮助增强自身的理解能力,更好的拓思维.
举一反三
例1: 【怎样又快又准确的做化学推导题.】[化学练习题]
思路提示:
抓住关键字眼,从沉淀的颜色及是否溶解、是否有气体生成等入手.
例:有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,沉淀完全溶解并有气体产生.由此推断白色固体中( )
A.可能存在NaOH B.可能存在Na2SO4 C.肯定不存在BaCl2 D.肯定存在Na2CO3和Na2SO4
分析:从白色沉淀遇酸全溶且有气体生成,推得沉淀是BaCO3不是BaSO4,白固中一定有Na2CO3、BaCl2,一定无Na2SO4,(因硫酸钡沉淀不溶于酸)可能有NaOH.
正确答案:A
例2: 高中化学的推断题怎么做?[化学练习题]
思路提示:
该了解的了解 该理解的理解 该掌握的掌握 该运用的运用
推断题:记住常见物质典型物理化学性质,如颜色,气味,溶解性,状态,多不氧化,两性,双水解等等,平时多归纳总结,推断题不难做的.安徽高考都已经不考无机框图题啦,没有生命力的.不过有机还是考.
各种大小知识点都要会 不然推到一半一个知识点不懂就玩完了 给个网上的推断题知识整理吧 我看过了基本的都有了~
1,物质颜色
红色:Fe2O3,Fe(OH)3,FeSCN2+,Cu2O,Cu,NO2,Br2(g),P;
橙色:Br2的溶液;
黄色:S,Na2O2,AgBr,AgI,Ag3PO4,Fe3+(aq),久置浓HNO3;
绿色:Fe2+(aq),绿矾,铜绿,浓CuCl2,Cu+浓HNO3;
蓝色:Cu2+(aq),胆矾,Cu(OH)2;
紫色:石蕊,KMnO4,I2(g),Fe3++C6H5OH;
黑色:多数过渡金属的氧化物以及硫化物,C,Fe等;
白色:CaCO3,BaSO4,AgCl,Mg(OH)2,Al(OH)3,MgO,Al2O3.
2,物质状态
液态单质:Br2,Hg;
液态化合物:H2O,H2O2,H2SO4,HNO3等;
气态单质:H2,N2,O2,F2,Cl2等;
气态化合物:C,N,S的氢化物及氧化物等.
3,反应现象或化学性质
(1)焰色反应:黄色—Na;紫色(钴玻璃)—K.
(2)与燃烧有关的现象:
火焰颜色:苍白色:H2在Cl2中燃烧;
(淡)蓝色:H2,CH4,CO 等在空气中燃烧;
黄色:Na在Cl2或空气中燃烧;
烟,雾现象:
棕(黄)色的烟:Cu或Fe在Cl2中燃烧;
白烟:Na在Cl2或P在空气中燃烧;
白雾:有HX等极易溶于水的气体产生;
白色烟雾:P在Cl2中燃烧.
(3)沉淀特殊的颜色变化:
白色沉淀变灰绿色再变红褐色:Fe(OH)2→Fe(OH)3;
白色沉淀迅速变棕褐色:AgOH→Ag2O.
(4)使湿润的红色石蕊试纸变蓝的气体:NH3;
(5)能使品红溶液褪色加热后又复原的气体:SO2;
(6)在空气中迅速由无色变成红棕色的气体:NO;
(7)使淀粉溶液变蓝的物质:I2;
(8)能漂白有色物质的淡黄色固体:Na2O2;
(9)在空气中能自燃的固体:P4;
(10)遇SCN-变红色,OH-产生红褐色沉淀,苯酚显紫色的离子:Fe3+;
(11)不溶于强酸和强碱的白色沉淀:AgCl,BaSO4;
(12)遇Ag+生成不溶于硝酸的白色,浅黄色,黄色沉淀的离子分别是:Cl-,Br-,I-.
(13)可溶于NaOH的白色沉淀:Al(OH)3,H2SiO3;金属氧化物:Al2O3;
(14)可溶于HF的酸性氧化物:SiO2;
(15)能与NaOH溶液反应产生气体的单质:Al,Si,;化合物:铵盐;
(16)能与浓硫酸,铜片共热产生红棕色气体的是:硝酸盐;
(17)通入二氧化碳产生白色胶状沉淀且不溶于任何强酸的离子:SiO32-;
(18)溶液中加酸产生的气体可能是:CO2,SO2,H2S; 溶液中存在的离子可能是:CO32-,HCO3-;SO32-,HSO3-;S2-,HS-;
(19)同一元素的气态氢化物和最高价氧化物对应水化物能反应生成盐的元素:N;
(20)与酸,碱都能反应的无机物:Al,Al2O3,Al(OH)3,弱酸酸式盐,弱酸弱碱盐等;
(21)能与水反应生成气体的物质:K,Na,NaH;Na2O2,CaC2及Mg3N2,Al2S3等;
(22)既有气体又有沉淀生成的反应:Ba(OH)2,Ca(OH)2与NH4HCO3,(NH4)2SO4等;
(23)先沉淀后溶解的反应:Ca(OH)2+CO2,AgNO3+氨水,Al3++OH-,AlO2-+OH-,Ba(OH)2+H3PO4 等;
(24)见光易分解的物质:HClO,HNO3,AgCl,AgBr,AgI;
(25)使用催化剂的反应:合成氨,三氧化硫的生成,氨的催化氧化,制氧气等.
4,特殊的反应类型: 往往是题目的隐性突破口.
(1)单质A + 化合物B → 单质C + 化合物D
即置换反应,可以是金属置换出金属(最常见的是铝热反应)或金属置换出非金属(被置换出来的非金属应该是还原产物,而还原产物在一定条件下具有一定的还原性,故通常是H2或C),也可以是非金属置换出非金属(常见的是卤素单质之间的置换或F2置换出O2,当然卤素都能置换出S,另外C可以置换出Si,H2)或非金属置换出金属(此时的非金属必作还原剂,而常见的还原性非金属只有C和H2).
(2)A 的化合物 + A的化合物 → A 的单质 + 化合物B
该反应通常是一个归中到单质的反应,该单质必为非金属单质,常见的是S,Cl2,N2.
(3)单质A + 强碱 →两种含A 元素的化合物
该反应是一个碱性歧化反应,单质A 通常是X2或S;
(4)单质A + 单质B → 化合物C ;C + 单质A → 化合物D
综合以上两个反应,可知A,B两种元素可以形成C,D两种以上的化合物,其中必定有一种元素有变价.若有变价的元素是金属,则必为Fe;若有变价的元素为非金属则该元素通常是C,N,S或O等,故以上C,D分别是NO,NO2或CO,CO2,或SO2,SO3或Na2O,Na2O2等.
(5)一种物质分解得到两种以上产物:
常见的有KMnO4,NaHCO3,NH4HCO3,(NH4)2CO3,NH4I,Cu2(OH)2CO3等的分解.
(6)多种物质化合得到一种物质:
如Fe(OH)2+O2+H2O;NOx+O2+H2O等
(7)电解类型(惰性电极):
生成两种产物:电解质分解型或电解水型或熔融的NaCl等.
生成三种产物:放氧生酸型或放氢生碱型.
生成三种气体:电解氨水或NH4Cl溶液.
(8)与化工生产有关的反应:
如制漂白粉,制生石灰,工业合成氨,氯碱工业,硫酸工业,硝酸工业,玻璃工业等.
——————特别添加有机部分——————
一基础知识:结构与性质的联系
1、由性质信息推测官能团或物质种类
(1).能使溴水和酸性高锰酸钾褪色的有机物常含有:"双键"或"叁键"等
(2).能发生银镜反应的有机物含有"醛基".
(3).能与Na发生反应产生H2的有机物含"羟基,羧基"
(4). 能与Na2CO3或NaHCO3溶液反应产生CO2的有机物含有"-COOH".
(5).能与NaOH溶液反应的有"酚羟基","—COOH"和"酯基".
(6).能与三氯化铁溶液发生显色反应,显紫色的有机物必有"酚羟基".
(7).能发生酯化反应的有机物含有"-OH"或"-COOH".
(8).能水解生成醇和酸的有机物含有"酯基".
(9). 能发生水解反应的物质有卤代烃,酯,低聚糖及多糖,蛋白质.
(10).能与氢气加成的有碳碳双键,碳碳叁键,碳氧双键(醛,酮)及苯环.
2、根据反应条件推测反应类型,反应物,生成物种类
(1).反应条件为浓或稀硫酸加热的反应有:醇的脱水(170℃,为消去生成烯的反应),酯化反应及水解,硝化反应等.
(2).反应条件为"NaOH溶液,Δ"的反应有:卤代烃的水解或酯的水解等
(3).反应条件为"NaOH溶液,醇溶液,Δ"只有卤代烃的消去
(4).反应条件为"铜或银,Δ"只有醇的氧化
(5).连续氧化为醇醛酸的衍变
二、根据有机物之间衍变关系推测物质种类或结构
1、根据有机物性质及相关数据推测官能团的个数
(1).由银镜反应中醛与生成银的物质的量关系推知含-CHO的个数.
若1mol醛生成2molAg,则醛分子中醛基个数为 1 .
若1mol醛生成4molAg,则醛分子中醛基个数为 2 或醛为 甲醛 .
由醛与新制氢氧化铜反应时生成生成Cu2O的物质的量关系推知含-CHO的个数.
若1mol醛生成1molCu2O,则醛分子中醛基个数为 1 .
若1mol醛生成2molCu2O,则醛分子中醛基个数为 2 或醛为 甲醛 .
.醇与Na反应,用醇与放出H2的物质的量关系判断-OH的个数.
若1mol醇生成0.5molH2,则醇分子中羟基个数为 1 .
若1mol醇生成1.0molH2,则醇分子中羟基个数为 2 .
.用羧酸与NaOH反应的量的关系判断—COOH个数
若1mol羧酸与1molNaOH恰好反应,则羧酸分子中羧基个数为 1 .
.用酯与酯水解生成一元醇或一元酸的物质的量关系推断酯基个数
若1mol酯水解生成1mol一元酸或一元醇,则酯分子中酯基个数为 1 .
若1mol酯水解生成2mol一元酸或一元醇,则酯分子中酯基个数为 2 .
(5).利用碳氢原子个数比确定
C:H=1:2的有机物为:烯烃,一元醛,一元羧酸及酯 ;C:H=1:1的有机物为:乙炔,苯,苯酚,苯乙烯 ;C:H=1:4的有机物为:甲烷,甲醇,尿素 .
(6).利用与饱和烃相比缺H数确定:
缺2个H: 含有一个碳碳双键或碳氧双键或含有一个环 ;缺4个H: 有两个不饱和键(碳碳双键或碳氧双键)或一个碳碳三键; 缺8个H: 苯及苯的同系物,酚类 ; 缺8个以上H: 有苯环和其他不饱和键;不缺H: 烷烃,醇,醚 .
(7).利用加成反应中量的关系判断分子中双键或叁键个数
1mol有机物加成1mol氢气,则有机物分子中有 1 个双键(可以是碳碳双键,也可以是醛或酮中的碳氧双键);1mol有机物加成2mol氢气,则有机物分子中有 2 个双键或 1 个碳碳叁键
2、根据反应产物推测官能团的位置
(1).由醇氧化为醛或酮及羧酸的情况,判断有机物的结构.当醇氧化成醛或酸时应含有"-CH2OH",若氧化为酮,应含有"-CH-OH"
(3).由消去反应产物可确定"-OH"和"-X"的位置.
(4).由取代产物的种数确定H的个数及碳架结构.
(5).由加氢后的碳架结构,确定"C=C"或"C≡C"的位置.
三.有机合成方法与规律
合成方法:①识别有机物的类别,含何官能团,它与何知识信息有关②据现有原料,信息及反应规律,尽可能合理把目标分子分成若干片断,或寻求官能团的引入,转换,保护方法或设法将各片断拼接衍变③正逆推理,综合比较选择最佳方案
合成原则:①原料价廉,原理正确②路线简捷,便于操作,条件适宜③易于分离,产率高
解题思路:①剖析要合成的物质(目标分子),选择原料,路线(正向,逆向思维.结合题给信息)②合理的合成路线由什么基本反应完全,目标分子骨架③目标分子中官能团引入
合成关键:选择出合理简单的合成路线;熟练掌握各类有机物的组成,结构,性质,相互衍变关系以及重要官能团的引入方法等基础知识.
四、官能团的引入:
官能团的引入
引入-OH
烯烃与水加成,醛/酮加氢,卤代烃水解,酯的水解
引入-X
烃与X2取代,不饱和烃与HX或X2加成,醇与HX取代
引入C=C
某些醇和卤代烃的消去,炔烃加氢
引入-CHO
某些醇氧化,烯氧化,炔水化,糖类水解
引入-COOH
醛氧化,苯的同系物被强氧化剂氧化,羧酸盐酸化,酯酸性水解
引入-COO-
酯化反应
相关思考练习题:
题1:中考化学推断题及答案解析 人教版
点拨:2010年中考化学实验试题精选汇编(一) 1、(2010山东烟台)正确的实验操作是科学探究成功的基矗下列操作中正确的是( ) (A)取用少量液体 (B)过滤 (C)闻气味 (D)稀释浓硫酸 答案:C 2、(2010山东烟台)A、B、C三只小烧杯内依次盛有一...
题2:一般化学的推断题怎么做好?
点拨:一、解题的一般思路 二、推断题的常见突破口 1.物质特征 ⑴ 固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4?5H2O(蓝色)、S(黄色). ⑵ 溶液颜色:含有Cu2+(蓝色);含有Fe2+(浅绿色);含有Fe3...
题3:初三化学推断题和流程题解题技巧
点拨:推断题和流程题解题技巧:看其颜色,观其状态,察其变化,初代验之,验而得。 1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。 2,一些特殊物质的颜色 黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁) 蓝色:CuSO4R...
题4:化学推断题中常考的是哪些物质(用来应付小高考)
点拨:无机中常有一些重要的金属像Fe Cu Mg Al 都很重要记住铁三角,铝三角间转换的方程式,像Fe和水在高温下反应生成四氧化三铁和氢气的方程式,总在无机推断中出现` 非金属像氢气 氧气 氟气 氯气 氨气 碳 硅 硫 还有相应的化合物等常用来推断 如果学...
题5:化学的推断题的解题技巧或方法
点拨:化学的推断题的解题技巧或方法如下: 1. 限定范围推断:主要适用于气体或离子的推断,该类题目的主要特点是在一定范围内,根据题目给出的实验现象(或必要的数据)进行分析,作出正确判断。解题关键:①审明题意,明确范围,注意题目所给的限定条...
热门曲谱
 刘德华喊话四大天王合体做节目:他们愿意我 彭于晏带违规水果过海关被罚 据台湾媒体报道,彭于晏7月1日返回台北在松山机场过海关的时候,因为不小心带了水果,被海关查获并罚款3000元台币 。有台湾媒体询问机场工作人...[详情]分类:知识库时间:12:37
刘德华喊话四大天王合体做节目:他们愿意我 彭于晏带违规水果过海关被罚 据台湾媒体报道,彭于晏7月1日返回台北在松山机场过海关的时候,因为不小心带了水果,被海关查获并罚款3000元台币 。有台湾媒体询问机场工作人...[详情]分类:知识库时间:12:37 led和节能灯哪个好
led和节能灯哪个好 概括:这道题是贲友颗同学的课后练习题,主要是关于led和节能灯哪个好,指导老师为黎老师。LED节能灯是继紧凑型荧光灯(即普通节能灯...
[详情]分类:知识库时间:14:47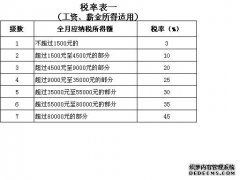 个人所得税税率
个人所得税税率 概括:这道题是蒲值暇同学的课后练习题,主要是关于个人所得税税率,指导老师为阚老师。
题目:个人所得税税率
解:<...[详情]分类:知识库时间:14:51 个税计算方法
个税计算方法 概括:这道题是文缘卣同学的课后练习题,主要是关于个税计算方法,指导老师为惠老师。负所得税制度的意义财税部门出台了给予弱势群...
[详情]分类:知识库时间:14:51 李光洁宣布结婚 彭于晏带违规水果过海关被罚 据台湾媒体报道,彭于晏7月1日返回台北在松山机场过海关的时候,因为不小心带了水果,被海关查获并罚款3000元台币 。有台湾媒体询问机场工作人...[详情]分类:知识库时间:12:37
李光洁宣布结婚 彭于晏带违规水果过海关被罚 据台湾媒体报道,彭于晏7月1日返回台北在松山机场过海关的时候,因为不小心带了水果,被海关查获并罚款3000元台币 。有台湾媒体询问机场工作人...[详情]分类:知识库时间:12:37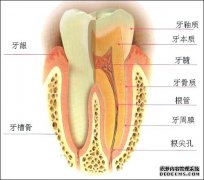 什么可以美白牙齿
什么可以美白牙齿 概括:这道题是贡泼俊同学的课后练习题,主要是关于什么可以美白牙齿,指导老师为井老师。冷光美白牙齿顾名思义就是用冷光来美白牙...
[详情]分类:知识库时间:14:58 什么是连带责任
什么是连带责任 概括:这道题是满澄檬同学的课后政治练习题,主要是关于什么是连带责任,指导老师为宦老师。
题目:什么是连带责任
...[详情]分类:知识库时间:14:58 趣头条与江苏卫视达成战略合作 彭于晏带违规水果过海关被罚 据台湾媒体报道,彭于晏7月1日返回台北在松山机场过海关的时候,因为不小心带了水果,被海关查获并罚款3000元台币 。有台湾媒体询问机场工作人...[详情]分类:知识库时间:12:37
趣头条与江苏卫视达成战略合作 彭于晏带违规水果过海关被罚 据台湾媒体报道,彭于晏7月1日返回台北在松山机场过海关的时候,因为不小心带了水果,被海关查获并罚款3000元台币 。有台湾媒体询问机场工作人...[详情]分类:知识库时间:12:37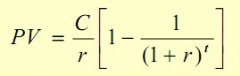 利率怎么算
利率怎么算 概括:这道题是从纲凑同学的课后练习题,主要是关于利率怎么算,指导老师为殳老师。银行利率表示一定时期内利息量与本金的比率,通...
[详情]分类:知识库时间:14:58 名贵树种
名贵树种 概括:这道题是山翁灿同学的课后练习题,主要是关于名贵树种,指导老师为谈老师。
题目:名贵树种
解: ...[详情]分类:知识库时间:14:56 埃利斯
埃利斯 概括:这道题是苏似涡同学的课后政治练习题,主要是关于埃利斯,指导老师为裴老师。
题目:埃利斯
解: ...[详情]分类:知识库时间:14:54 差异
差异 概括:这道题是巫唐抖同学的课后练习题,主要是关于差异,指导老师为左老师。暂时性差异是由税收法规与会计准则确认时间或计税基础...
[详情]分类:知识库时间:14:53 平衡梁
平衡梁 概括:这道题是浦晓淖同学的课后练习题,主要是关于平衡梁,指导老师为赵老师。平衡梁为吊装机具的重要组成部分,可用于保持被吊设...
[详情]分类:知识库时间:14:54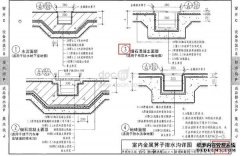 建筑图集
建筑图集 概括:这道题是蓟侠位同学的课后政治练习题,主要是关于建筑图集,指导老师为焦老师。《新疆传统建筑图集》是2009年新疆科学技术出...
[详情]分类:知识库时间:14:54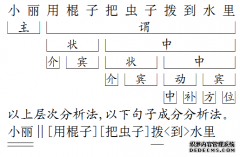 成分分析
成分分析 概括:这道题是颜仑徽同学的课后练习题,主要是关于成分分析,指导老师为戈老师。
题目:成分分析
解: ...[详情]分类:知识库时间:14:56 无坚不摧之力
无坚不摧之力 概括:这道题是路婆掖同学的课后政治练习题,主要是关于无坚不摧之力,指导老师为祁老师。
题目:无坚不摧之力
解:<...[详情]分类:知识库时间:14:54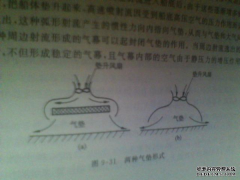 气垫船原理
气垫船原理 概括:这道题是席洞朴同学的课后练习题,主要是关于气垫船原理,指导老师为毛老师。通风工程是送风、排风、除尘、气力输送以及防、...
[详情]分类:知识库时间:14:54 海狸
海狸 概括:这道题是项筛卦同学的课后练习题,主要是关于海狸,指导老师为钱老师。
题目:海狸
解: ...[详情]分类:知识库时间:14:56 38译码器
38译码器 知识点:《38译码器》 收集:瞿收霉 编辑:桂花
[详情]分类:知识库时间:10:57
本知识点包括:1、38译码器在单片机系统中的作用是什么? 2、求vh... aidma
aidma 知识点:《aidma》 收集:蒯超峦 编辑:栀子花女孩
[详情]分类:知识库时间:12:08
本知识点包括:1、SOV/SOM是什么?AIDMA和AIDAS理论代表什么...
